NUMELVI®

TABLETAS PARA TRATAMIENTO DEL PRURITO, LA INFLAMACIÓN Y LAS MANIFESTACIONES CLÍNICAS ASOCIADAS CON LA DERMATITIS ALÉRGICA EN PERROS
FÓRMULA:
Cada tableta contiene:
Atinvicitinib: 4.8 mg, 7.2 mg, 21.6mg ó 31.6 mg
Excipientes c.s.p 1 tableta
Composición cualitativa de los excipientes y otros componentes:
Celulosa microcristalina, Lactosa monohidrato, Almidón glicolato de sodio (tipo A), Tocofersolán,
Hidroxipropilcelulosa, Sílice coloidal anhidra, Estearato de magnesio
DESCRIPCIÓN:
Numelvi® es un inhibidor JAK de segunda generación para tratar el prurito, la inflamación y las manifestaciones
clínicas de todos los casos de dermatitis alérgica en perros. Numelvi® es 10 veces más selectivo para JAK-1,
seguro para perros de más de 6 meses de edad y de 2 kg de peso o mayores y de aplicación única al día.
INDICACIONES:
Para el tratamiento del prurito, la inflamación y las manifestaciones clínicas asociadas con la dermatitis alérgica,
incluida la dermatitis atópica en perros.
ESPECIES DESTINO:
Perro
FORMA FARMACÉUTICA:
Administración oral.
Tabletas de color blanco a blanquecino, de forma oblonga, ranuradas para su fraccionamiento y
marcadas con «S», «M», «L» o «XL» en cada mitad. Las letras «S», «M», «L» y «XL» se refieren a las
diferentes concentraciones de las tabletas: «S» está en las tabletas de 4.8 mg, «M» en las tabletas de 7.2 mg, «L»
en las tabletas de 21.6 mg y «XL» en las tabletas de 31.6 mg.
PRESENTACIÓN:
Blísteres de aluminio (cada uno contiene 30 tabletas) en cajas de 30 y 90 tabletas.

DOSIS Y VÍA DE ADMINISTRACIÓN:
Vía oral.
0.8 a 1.2 mg de atinvicitinib/kg de peso corporal
El medicamento debe administrarse una vez al día, al momento de la alimentación o a una hora cercana a esta,
de acuerdo con la siguiente tabla de dosificación:
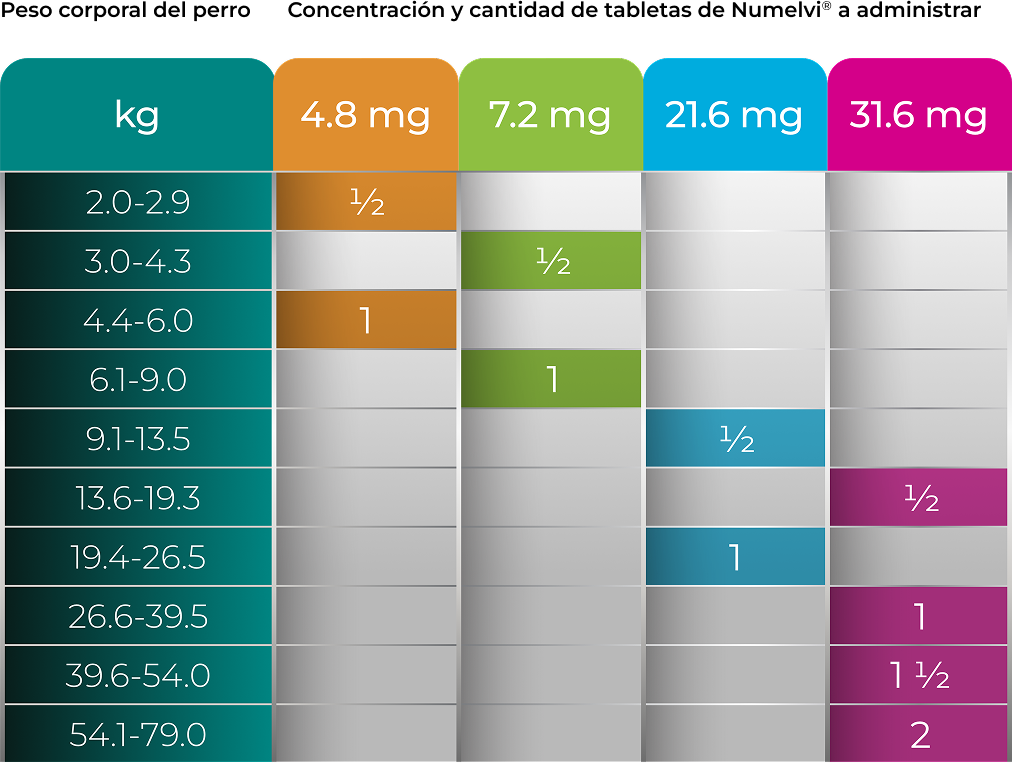
Para perros con un peso corporal superior a 79 kg, usar una combinación de tabletas enteras o mitades para
alcanzar la dosis objetivo de 0.8 – 1.2 mg/kg de peso corporal
PROPIEDADES FARMACODINÁMICAS:
El atinvicitinib es un inhibidor selectivo de la cinasa Janus (JAK), altamente selectivo para JAK-1. Inhibe la
función de una variedad de citocinas involucradas en el prurito y la inflamación, así como citocinas involucradas
en la alergia, que dependen de la actividad enzimática de JAK-1.
El atinvicitinib es al menos diez veces más selectivo para JAK-1 en comparación con los otros miembros de la
familia JAK (JAK-2, JAK-3, TYK-2). Por lo tanto, tiene poco o ningún efecto sobre las citocinas involucradas en
la hematopoyesis o la respuesta inmunológica del hospedero que dependen de JAK-2 o los otros miembros de
la familia JAK.
PROPIEDADES FARMACOCINÉTICAS:
Tras la administración oral, el atinvicitinib se absorbió rápida y adecuadamente con una Cmax media observada de 190 ng/ml, que se produjo aproximadamente 1 hora (tmax) después de la administración. La biodisponibilidad absoluta del atinvicitinib después de la administración una vez al día durante cuatro días fue de aproximadamente el 65%. La biodisponibilidad fue mayor en perros alimentados. El tiempo de retiro corporal total del atinvicitinib en el plasma fue de 1,074 ml/h/kg de peso corporal (17.9 ml/min/kg de peso corporal), y el volumen de distribución aparente en estado estacionario fue de 1,651 ml/kg de peso corporal. Tras la administración oral, la semivida terminal (T1/2) fue de 2 horas.
El atinvicitinib tiene una unión a proteínas moderada, con un 82.3% unido en plasma canino fortificado a
concentraciones de 1,802 ng/ml (5 M).
El atinvicitinib se metaboliza en el perro a múltiples metabolitos. La vía general de eliminación es el metabolismo con excreción en las heces, mientras que la eliminación renal con excreción en orina es una vía menor.
CONTRAINDICACIONES:
No utilizar en caso de hipersensibilidad a las sustancias activas o a alguno de los excipientes.
REACCIONES ADVERSAS:
No se observaron reacciones adversas relacionadas con el tratamiento en los ensayos clínicos.
Reacciones adversas comunes (de 1 a 10 animales/100 animales tratados): Emesis, diarrea, letargo, disminución
del apetito leves que se resolvieron por si mismo, sin necesidad de tratamiento.
ADVERTENCIAS:
Ninguna
PRECAUCIONES ESPECIALES:
Precauciones para su uso en animales:
En ausencia de datos disponibles, el medicamento para uso veterinario no debe utilizarse en perros menores a 6
meses de edad.
Se recomienda investigar y tratar los factores que complican la enfermedad, como infecciones bacterianas,
fúngicas o parasitarias (p. ej., pulgas, ácaros Demodex), así como cualquier causa subyacente (p. ej., alergia a las
pulgas, alergia por contacto, alergia alimentaria) de la dermatitis alérgica y atópica.
Precauciones que debe tomar la persona que administra el producto veterinario a los animales:
Lavarse bien las manos con agua y jabón inmediatamente después de usar el medicamento para uso veterinario.
Gestación, lactancia y fertilidad:
No se ha establecido la seguridad del medicamento para uso veterinario durante la gestación y la lactancia o en
perros de cría. Por lo tanto, no se recomienda el uso en estos perros.
Interacción con otros medicamentos y otras formas de interacción:
Ninguna conocida. No se observaron interacciones medicamentosas en los estudios de campo donde el
medicamento para uso veterinario se administró de forma concomitante con otros medicamentos para uso
veterinario como antimicrobianos (incluidos los tópicos), ectoparasiticidas y endoparasiticidas (isoxazolinas,
milbemicinas, avermectinas, piretrinas y piretroides), analgésicos, anestésicos, suplementos nutricionales, limpiadores tópicos para piel y oídos que no contengan glucocorticoides, así como champús medicados. El riesgo de interacciones medicamentosas es muy bajo debido al efecto limitado del atinvicitinib sobre el citocromo P450.
No hubo impacto en la respuesta inmunitaria a la vacunación. El medicamento para uso veterinario fue bien
tolerado sin efectos clínicos adversos relacionados con el tratamiento cuando se usó de forma concomitante con la vacunación. Se logró una respuesta inmunitaria adecuada (serología) a la vacunación contra el adenovirus
canino tipo 2 modificado vivo (CAV), el virus del moquillo canino modificado vivo (CDV), el parvovirus canino
modificado vivo (CPV) y el virus de la rabia inactivado (RV) cuando se administró el medicamento para uso
veterinario a cachorros de 6 meses de edad sin vacunar previamente a una dosis de 3.6 mg/kg de atinvicitinib (3
veces la dosis máxima recomendada) una vez al día durante 84 días.
Sobredosis (signos, procedimientos de emergencia y antídotos):
El producto tiene un amplio margen terapéutico y fue bien tolerado cuando se administró por vía oral a cachorros sanos de 6 meses de edad tratados con sobredosis de hasta 5 veces la dosis máxima recomendada una vez al día durante un periodo de 6 meses.
En caso de efectos adversos después de una sobredosis, el perro debe recibir tratamiento sintomático.
Incompatibilidades:
Ninguna conocida
Precauciones de Almacenamiento:
Conservar el producto en su envase original, en un lugar fresco y seco, por debajo de 30°C, protegido de la luz
solar y fuera del alcance de niños y animales domésticos. No refrigerar ni congelar.
Cualquier mitad de tableta restante debe guardarse en su envase original.
Las mitades de tabletas restantes de los blísteres abiertos deben desecharse después de 9 días.
PRECAUCIONES PARA LA ELIMINACIÓN DEL PRODUCTO NO UTILIZADO O LOS MATERIALES DE DESECHO:
Todo medicamento veterinario no utilizado o los materiales de desecho derivados de dichos medicamentos
veterinarios deben eliminarse de acuerdo con los requisitos locales.
INFORMACIÓN ADICIONAL:
PARA USO VETERINARIO EXCLUSIVAMENTE.
CONSULTE AL MÉDICO VETERINARIO.
SU VENTA REQUIERE RECETA MÉDICA.
ELABORADO POR:
Intervet GesmbH.
Siemensstraße 107, 1210
Viena – Austria
IMPORTADO Y DISTRIBUIDO POR:
INTERVET CENTRAL AMERICA S DE RL
Bajo Licencia de Intervet International B.V.
